



栓塞微球是一类通过血管内途径递送,主动阻塞靶血管以实现治疗目的的生物相容性材料,以无菌形式提供,一次性使用。
一、产品组成
栓塞微球常由聚乙烯醇(PVA)为主的交联聚合体组成,根据微球尺寸和装量的不同分为不同规格。PVA栓塞微粒为多孔的不规则粒子,必须与造影剂混合后显影。
二、适用范围
栓塞微球临床上用于富血管型肿瘤及动静脉畸形的血管内栓塞治疗。
三、风险管理分类
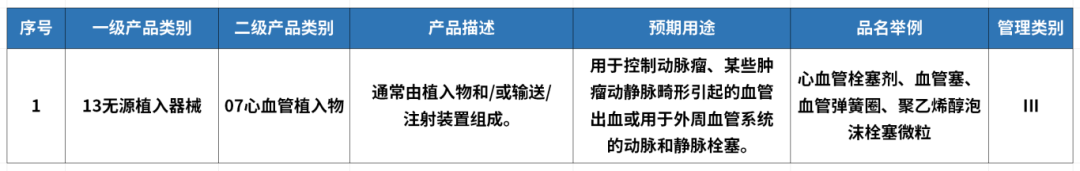
在我国的医疗器械注册管理分类目录13无源植入器械下,栓塞微球的风险等级管理类别为Ⅲ类。
四、注册单元划分原则和实例
栓塞微球注册单元原则上以产品的工作原理、结构组成、性能指标和适用范围等因素为划分依据。
1.产品的原材料不同需划分为不同注册单元。
如聚乙烯醇(PVA)、明胶、海藻酸钠等材料的栓塞微球,需分属不同单元。
2.关键工艺不同需划分为不同注册单元。
如不同灭菌方式(环氧乙烷、辐照)影响产品性能(膨胀率、无菌保证),则需分属不同单元。
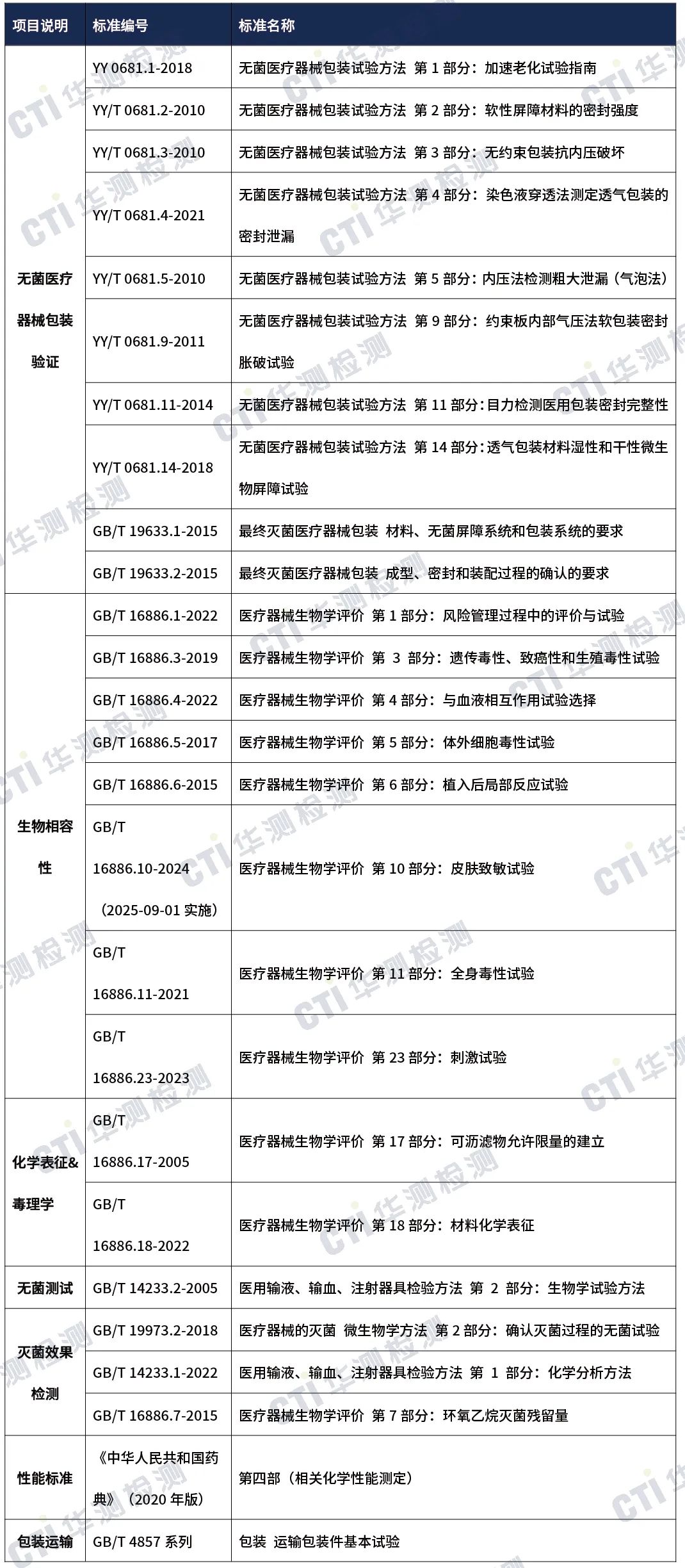
五、产品常见标准
·国内注册-检测方案
·国外注册-检测方案
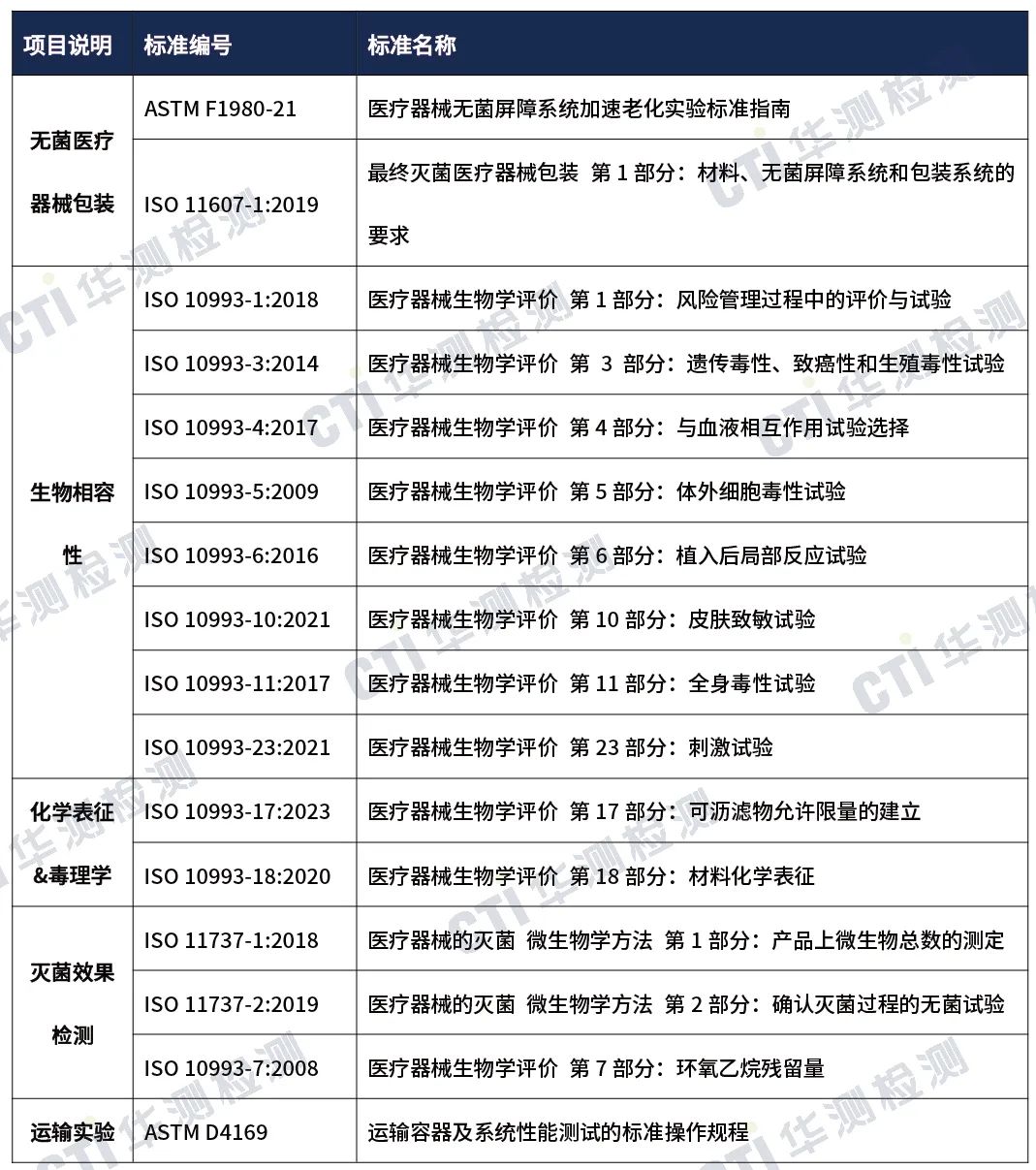
备注:上述标准包括了产品技术要求中经常涉及到的标准;企业需要根据产品的特点引用其他适用的标准。更多材料学相关测试,如需验证,南宫NG28集团可进行内部分包测试。
六、临床前大动物实验
建议选用猪模型,若选择其他动物模型,企业应结合产品成分或用途,对选择模型的合理性进行论证。
关键用途评价指标:肾脏栓塞模型的建立、DSA显影性、微导管通过性,栓塞效果及术后栓塞处组织学分析。
评价指标:一般性观察、肝肾等脏器功能性观察、血常规和凝血功能,H&E染色等
CTI南宫NG28检测医疗器械服务
CTI南宫NG28检测医疗器械实验室目前已经获得了以上测试标准的CNAS、CMA授权,测试项目包括生物相容性测试、理化试验、无菌包装验证、包装运输、材料化学表征及毒理学评估、临床前大动物实验等,尤其是可为企业提供符合FDA-GLP实验室规范的生物相容性实验,旨在为医疗器械生产企业提供【栓塞微球】全球市场准入的一站式注册检测服务方案。